今年诺贝尔生理学或医学奖授予了三名美国科学家:杰弗里·霍尔(Jeffrey C. Hall),迈克尔·拉斯巴什(Michael Rosbash)和麦克·杨(Michael W.Young)。以奖励他们在“生物节律的分子机制方面的发现”。
小编今天分享一篇《黏连蛋白介导的远程互作揭示节律基因的表达》(Long-Range Chromosome Interactions Mediated by Cohesin Shape Circadian Gene Expression),对科学的致敬。
古人很早就认识到万法自然的重要性,并把很多自然规律作为规范自身的准则,如《庄子.让王》提到日出而作,日入而息,逍遥于天地之间而心意自得。就明确地把太阳的东升西落作为饮食起居的重要标准。
地球自转导致的昼夜交替对高等动物有什么影响呢,霍尔和拉斯巴什首次在果蝇里克隆到per基因,这个蛋白翻译产物可以作为一个转录抑制因子,它可以通过抑制自身的表达而产生周期性的节律。而后杨发现了另外一个节律基因tim,值得一提的是中科院的孙中生老师在哺乳动物中发现了两个关键的生物钟基mPer1和mPer2,并取得了一系列的重要的成果。
昼夜节律是存在于各个生物体系中昼夜交替周期性的生理过程及行为。在哺乳动物中内源性的生物时钟是由相互关联的转录翻译反馈环路控制的,其中就包括Bmal1,Clock,Nrld1,Nrld2,Per以及Cry家族基因。如转录因子复合物BmaI-Clock 通过顺式调控元件Ebox驱动Nr1d1, Nr1d2, Per 及Cry 基因家族的表达;相反,Per 和 Cry蛋白通过蛋白与蛋白的互作可以抑制Bma1-clock的转录活性。此外,转录抑制因子Nr1d1,Nr1d2通过视黄素相关受体反应元件来抑制Bma1 的转录。
在哺乳动物中,视交叉上核或称下丘脑视交叉上核(suprachiasmatic nucleus, SCN)是哺乳动物昼夜节律调节系统的中枢结构,产生和调节睡眠—觉醒、激素、代谢和生殖等众多生物节律。它指导外周组织的组织特异性地生物钟,通过转录组分析技术发现小鼠肝脏中的节律振荡基因(COGS)的转录水平呈现24小时周期性振荡。
通过研究发现许多昼夜节律基因的循环曲线与昼夜转录因子的近距离结合并不一致,对数千个基因进行有规律的调控对于机体而言显然是一个浩大的工程。转录因子是一以贯之地调控所有基因还是通过一类的层级化调控,通过调控一类调控元件,然后由这些调控元件再次调控特定的基因。
于是作者推测昼夜振荡基因是否是先收到超级增强子的调控,而超级增强子则被特定的转录因子激活?
在前面的文章中,我们介绍过在生物体内染色质区域性的物理互作在基因调控等很多方面扮演了重要的作用,如增强子激活基因的转录和ploycomb复合物导致基因沉默等。在拓扑学相关结构域(TAD)的边界会富集CTCF蛋白,而cohesin是一种染色质结构蛋白,它在姐妹染色质联会以及染色质重塑过程中扮演了重要的作用,cohesin具有四个Subunits:Smc1, Smc3, Scc1(RAD21),SCC3(stag1,stag2) ,有报道指出Cohesin与CTCF结合会阻断增强子的活性从而抑制基因的表达,而Cohesin独立的结合位点则被报道是细胞特异性的,通常于转录因子的结合位点关联。
因此作者围绕着昼夜振荡基因是否受到特定增强子的调控这一科学假设进行了研究。
1.首先进行增强子的识别:
利用ChIP-seq的数据,作者得到了在节律调控中具有重要的转录因子Bma1的结合位点;并结合H3K4me1,H3K27ac组蛋白的ChIP-seq数据进行Overlap,鉴定了全基因组范围内3244个有Bma1结合的增强子,并将Bma1结合信号最强的3%的增强子定义为超级增强子。
2.其次是验证增强子是否调控昼夜振荡基因:
为了证实增强子与启动子的互作调控影响了基因的表达,他们选取了一个节律基因Nrld1上游8kb的超级增强子来进行研究。
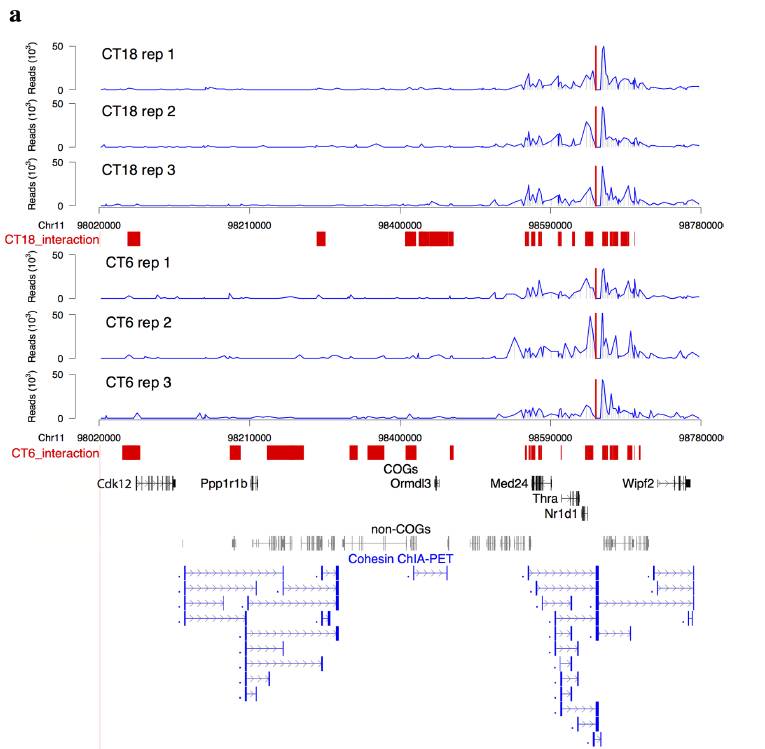
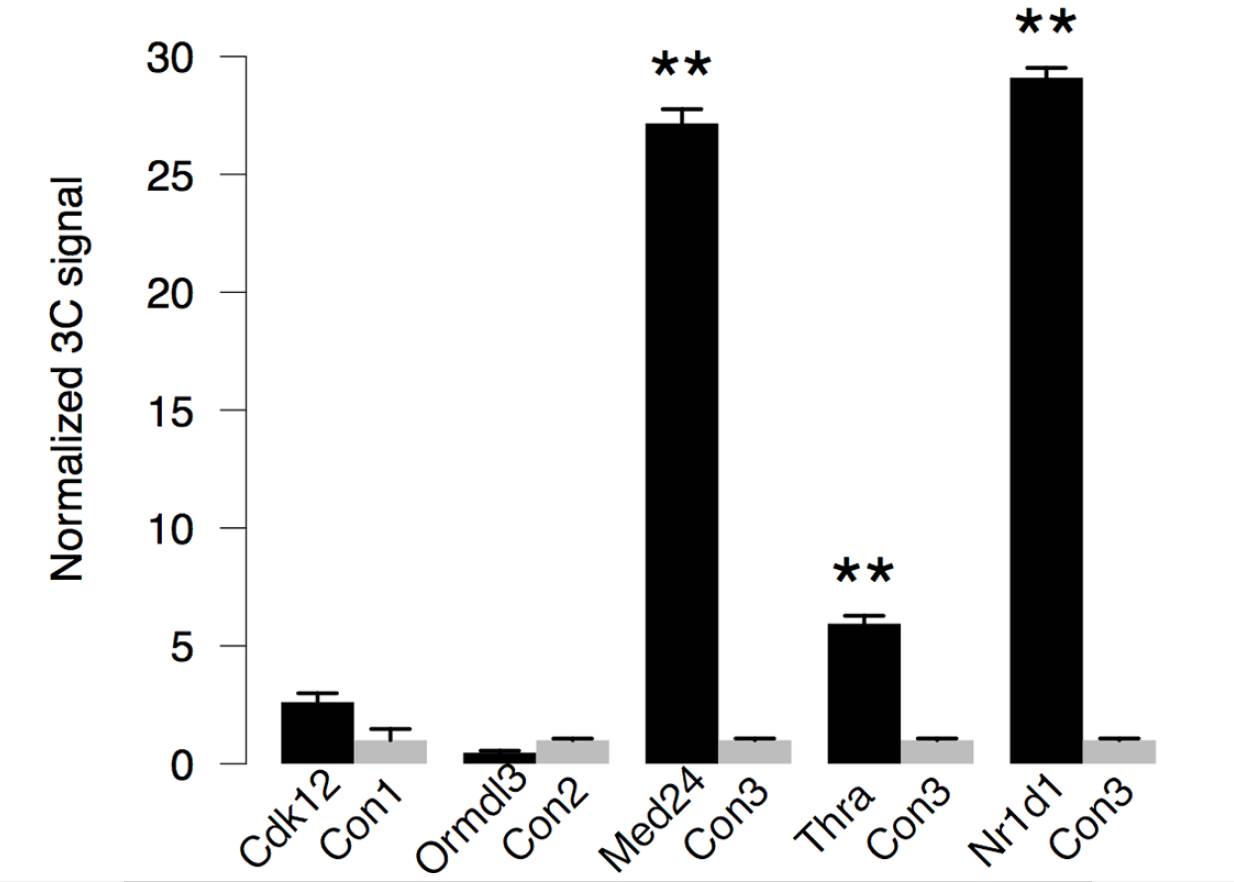
以超级增强子作为bait,进行4C实验,发现在CT6 中节律振荡基因Fbxl20, Cdk12, Med24, Thra, 和Nr1d1都与增强子存在显著互作另一个节律振荡基因Cdk12与增强子存在较弱的互作,而一个非节律振荡基因Ormdl3,则显示比对照更弱的相互作用,利用3C-定量PCR实验表明,Nr1d1, Thra, Med24与增强子的互作相比邻近的片段具有6-30倍的富集。
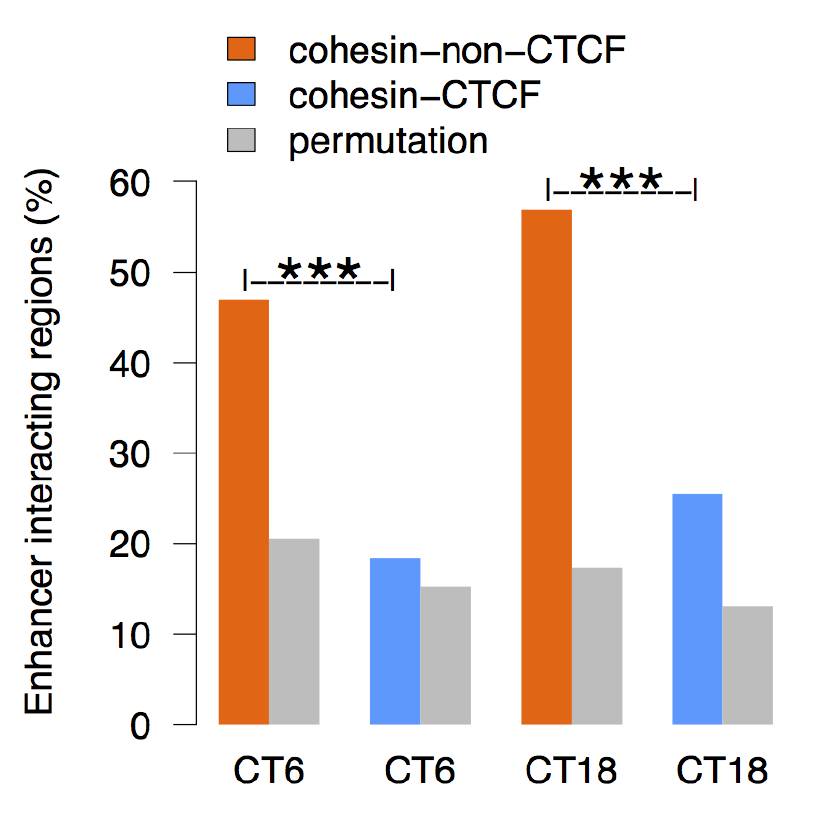
有趣的是,作者发现这些强的相互作用数据在mES cohesin ChIA-PET的数据中得到证实,而在CTCF ChIA-PET的数据中未发现。这暗示在小鼠胚胎干细胞中cohesin参与了Nrld1 Enhancer的远程互作。在本文的数据中,作者也考察了那些在CT6和CT8比较宽范围的相互作用区域(Fig1红色色块大的区域),发现具有50%的区域与cohesin-non-CTCF 位点有重合,而只有20%的区域是cohesin-CTCF位点重合。在figure2中他们发现在超级增强子中cohesin具有高丰度的富集。因此他们认为cohesin参与了节律增强子-启动子相互作用的形成。
3.研究Enhancer-Target的分子机制:
为了验证昼夜基因的表达与染色质结构蛋白的关系。他们分析了在超级增强子上下游组蛋白以及Bma1/cohesin/CTCF的情况,发现增强子核心区域有cohesin的富集,而CTCF则没有显著的富集,同时他们还考察了增强子区域Interaction cohesin和CTCF富集的情况,发现无论是CT6还是CT8 cohesin-non-CTCF的比例都高于cohesin-CTCF组。
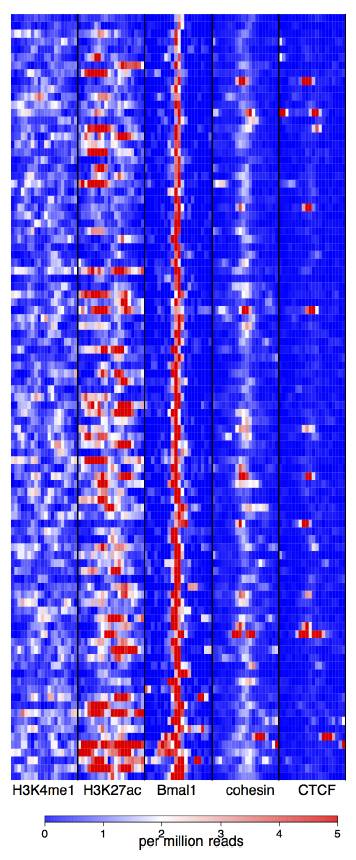
Cohesin-CTCF co-binding sites被认为是在基因组中扮演了绝缘子的角色,为了验证CTCF-cohesin位点是否影响基因的表达,他们比较了相邻的昼夜振荡基因是否时相发生变化。他们发现相较于随机组和Bma1,Nrd1组,cohesin-non-CTCF组介于两者之间,其昼夜指数要高于Gabpa(非昼夜转换基因)和cohesin-CTCF组,表明Cohesin-non-CTCF对于昼夜转换有正相关,同时分析cohesin-CTCF与cohesin-non-CTCF结合位点中Bma1和Nrd1结合位点分布频率,结果表明cohesin-non-CTCF位点Bma1和Nrd1的结合要远高于cohesin-CTCF组。
4.确证Cohesin参与的互作是否影响了基因的表达。
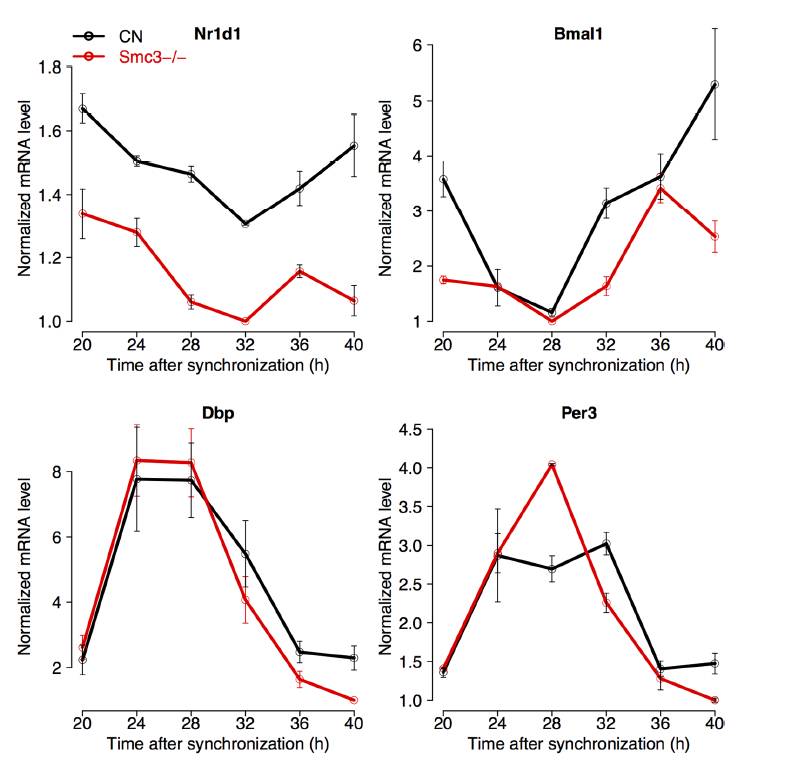
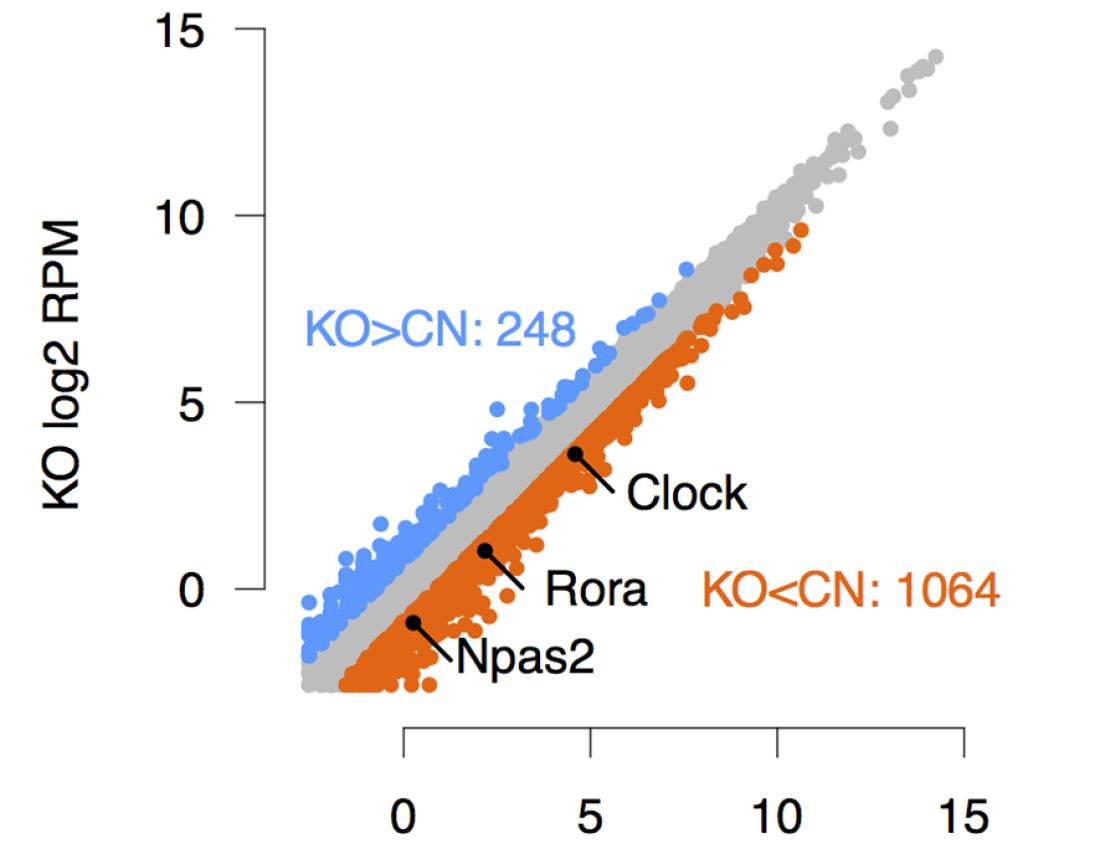
为此作者还通过模型证实了昼夜基因的调控受到cohesin/CTCF调控,并通过KO
黏连蛋白SMC3亚基考察节律蛋白的表达。发现节律基因表达明显下调。(根据讨论内容展示有删减,请读者自行阅读原文献)
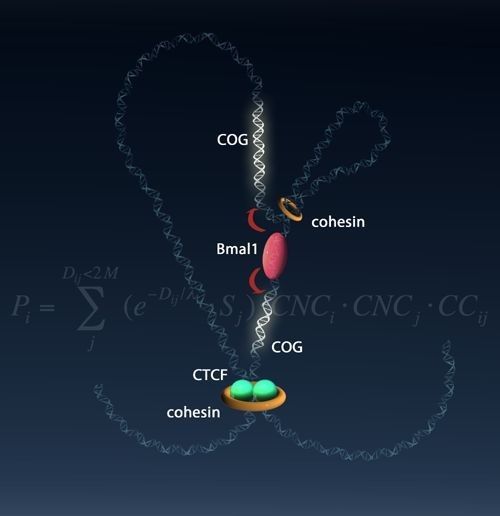
在讨论部分作者认为转录因子结合在增强子区域可能作为一个转录工厂,调控相关基因的表达,通过4C实验揭示了一个在染色质高级结构中昼夜振荡基因调控的情景,但是由cohesin介导的远程互作调控模型仍然需要得到更多数据的证实。
这篇文章的特色在于将染色质结构的因素考虑特定基因家族的调控中,利用4C技术对某一个特定的调控元件进行系统性分析,再验证其分子机制,提出新的模型进行验证,整体思路非常明确。这是值得学习的地方。
原文:
Xu Y, Guo W, Li P, et al. Long-range chromosome interactions mediated by cohesin shape circadian gene expression[J]. PLoS genetics, 2016, 12(5): e1005992.




共有条评论 网友评论