
随着目前科技的发展,制药企业自动化的水平在逐步的提高,在生产过程中运用到了越来越多的计算机化系统,然而这些计算机化系统专业属性强,制药企业难以正确的识别其潜在的风险,造成了风险识别的困难。并且目前国家对于数据完整性越来越重视,已经有多个国家/组织已经将计算机化系统作为单独的附录发布。我国在2015年5月,正式颁布了关于计算机化系统和确认与验证这两个附录,并且在2015年12月1日,开始实施检查。
从东富龙多年计算机化系统咨询与验证实施经验讲,国内大多药企扔停留在观望状态,其实这是一种抱有侥幸的心理,殊不知这种高枕无忧的日子已经结束,近几年不管是国外还是国家药监局的飞检,重灾区依然是QC实验室,但目前也有往生产药机设备检查的趋势,同时开出的缺陷项必有一项涉及到数据完整性方面,内容不外乎数据造假、恶意篡改或删除数据、预进样、数据未有效备份或电子签名等等。计算机化系统的验证也许看起来非常的高、大、上,其实在过去的设备验证过程中,一系列的验证文档包括URS、FDS、HDS、SDS、DQ、IQ、OQ、PQ、RAR、RTM、VSR等等都是相辅相成,共同点是相通的,很多计算机化系统的验证活动在我们设备的验证过程中已经包含,但是仔细再看,做的却层次不齐,不够深入,一个“符合要求”,“符合规定”就“完美的”解决了验证,其实法规要求我们去展现的是整个过程,这一点也正是我们绝大数药企做的不够深入的。再者,对于我们制药人,要学会对现有系统分类,根据分类结果与验证V模型,针对性的拆解系统模块,可以从业务层面、也可以从GMP数据关联方面,形成每个模块需要验证的重点功能点与次要功能点,但需要明确的是对于Part 11及药政法规要求的功能:审计追踪、用户访问、权限分级、电子签名、数据备份等要严格的深入的进行系统测试。这一点也是毋庸置疑的,也是药监局检查的重点。
那么我们如何来进行计算机化系统验证,首先,我们需要确定哪些是属于需要验证的系统和设备。对于具体系统验证的测试项目无论系统大小、复杂程度、成熟程度均应根据制药验证的原则,验证项目根据系统与GxP的关联程度与作用。运用SIA(系统影响性评估)评估系统对法规符合性和研发、生产、销售等环节对患者安全、产品质量安全和数据完整性的影响。根据评估的结果确认是否对系统进行完整的验证或是简单的检查。例如:
类别 | 系统 |
实验室 | LIMS、CDS、HPLC、GC、UV、LC-MS…… |
企业资源与物料 | ERP、WMS、BPCS |
生产过程 | MES、SCADA、PLC(各类药机设备)、DCS |
质量管理 | EDMS、QMS、CAPA、ADR |
根据风险、复杂性和新颖性,可以对计算机化系统软件进行分类。通过分类可以为特定系统选择最合适的验证活动。
类型 | 描述 |
1.基础架构软件 | 分层式软件(如应用程序开发基础) 用于管理操作环境的软件 |
3.不可配置 | 运行时间参数可能可以设置和存储,但是软件不能配置以适应商业流程 |
4.可配置 | 通常是非常复杂的软件,能够被用户进行配置以适用于用户特定商业流程需要。 并不需要改变软件代码。 |
5.定制 | 客户化设计软件并编程以适用于商业流程 |
根据系统的关键性和系统分类结果,我们可与得出各类系统的验证活动。例如:第三类验证。
用户需求 | 包括系统功能需求、法规要求、文件要求、售后服务、培训要求、验证要求等。 |
基于风险的供应商评估 | 对于成熟的、知名的品牌、具有使用经验的产品可不需要进行供应商评估。 |
风险评估 | 可以使用简单的评估方法,如初步危害分析PHA方法进行评估。 |
设计确认 | 核实供应商提供的技术文件中参数是否满足用户需求要求。 |
安装确认 | 1.环境检查 2.根据供应商技术资料安装软件 3.验证软件所有文件均已安装完成 4.备份软件 5.配置外设的打印机和仪器模块 6.识别和记录所有硬件、基础软件、应用程序 7.I/O测试(若有) 8.图纸检查(若有) 9.网络测试 10.仪器校准 |
运行确认 | 1.基于风险评估结果确认验证项目 2.功能测试 3.系统安全性测试 4.报警、互锁功能测试 5.数据的采集及存贮 6.确认数据处理能力 7. 电子签名 8.数据输出功能 9.接口测试 11.定时器和定序器测试 12.审计追踪功能测试 13.断电/恢复测试 14.灾难恢复测试 |
性能确认 | 确认其运行稳定性。 |
验证报告 | 总结验证的结果,确认验证结果是否符合预期结果,偏差、变更处理情况。 |
风险回顾报告 | 总结验证的结果,确认验证结果是否符合预期结果,偏差、变更处理情况。 |
追溯矩阵 | 追溯所有需求的满足性。 |
配置管理和变更控制 | 确保在系统生命周期内合规。 |
SOPs | 使用、维护、备份、恢复、业务持续性计划等. |
Part11评估报告 | 适用于过国外认证。 |
在确认系统类型属于哪一类验证活动后,将会进行验证活动,验证流程依据下面的流程图进行:
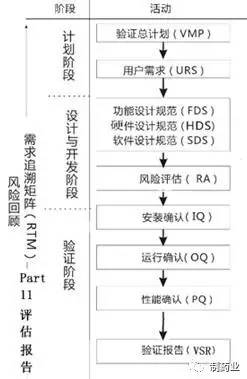
在验证完成后,结合计算机化系统验证范围情况,交付文件目录如下:(以冻干粉针车间为例)
序号 | 文件名称 | 文件编号 |
1 | 冻干粉针车间计算机化系统用户需求 | |
2 | 冻干粉针车间计算机化系统功能设计规范 | |
3 | 冻干粉针车间计算机化系统硬件设计规范 | |
4 | 冻干粉针车间计算机化系统软件设计规范 | |
5 | 冻干粉针车间计算机化系统风险评估 | |
6 | 冻干粉针车间计算机化系统验证安装确认方案 | |
7 | 冻干粉针车间计算机化系统验证安装确认报告 | |
8 | 冻干粉针车间计算机化系统验证运行确认方案 | |
9 | 冻干粉针车间计算机化系统验证运行确认报告 | |
10 | 冻干粉针车间计算机化系统验证性能确认方案 | |
11 | 冻干粉针车间计算机化系统验证性能确认报告 | |
12 | 冻干粉针车间计算机化系统需求追溯矩阵 | |
13 | 冻干粉针车间计算机化系统风险评估报告 | |
14 | 冻干粉针车间计算机化系统验证总结报告 | |
15 | 冻干粉针车间计算机化系统Part11评估报告 |
在首次验证完成后,应当通过相关程序的控制,确保药企使用的计算机化系统维持持续的验证状态。相关的支持性程序包括但不限于以下:
●偏差处理
●变更控制
●培训与考核
●校准
●预防性维护
●再验证
案例:
QC实验室计算机化系统分类清单
序号 | 系统名称 | 分类结果 |
HPLC | 4类 | |
IR | 4类 | |
UV | 4类 | |
GC | 4类 | |
LC-MS | 4类 | |
CDS | 4类 | |
LIMS | 4类 |
实验室验证文件目录(Empower3)
序号 | 文件名称 | 文件编号 |
Empower3用户需求 | URS-01-01-01 | |
Empower3系统功能设计规范 | FDS-01-01-01 | |
Empower3系统硬件设计规范 | HDS-01-01-01 | |
Empower3系统软件设计规范 | SDS-01-01-01 | |
Empower3 Server风险评估 | RA-01-01-01 | |
Empower3 LAC/E风险评估 | RA-01-02-01 | |
Empower3客户端风险评估 | RA-01-03-01 | |
Empower3 Server安装确认方案 | IQP-01-01-01 | |
Empower3 Server安装确认报告 | IQR-01-01-01 | |
Empower3 LAC/E安装确认方案 | IQP-01-02-01 | |
Empower3 LAC/E安装确认报告 | IQR-01-02-01 | |
Empower3客户端安装确认方案 | IQP-01-03-01 | |
Empower3客户端安装确认报告 | IQR-01-03-01 | |
Empower3 Server运行确认方案 | OQP-01-01-01 | |
Empower3 Server运行确认报告 | OQR-01-01-01 | |
Empower3 LAC/E运行确认方案 | OQP-01-02-01 | |
Empower3 LAC/E运行确认报告 | OQR-01-02-01 | |
Empower3客户端运行确认方案 | OQP-01-03-01 | |
Empower3客户端运行确认报告 | OQR-01-03-01 | |
Empower3性能确认方案 | PQP-01-01-01 | |
Empower3性能确认报告 | PQR-01-01-01 | |
Empower3需求追溯矩阵 | RTM-01-01-01 | |
Empower3 Server风险回顾报告 | RAR-01-01-01 | |
Empower3 LAC/E风险回顾报告 | RAR-01-02-01 | |
Empower3客户端风险回顾报告 | RAR-01-03-01 | |
Empower3验证总结报告 | VSR-01-01-01 |
无菌车间计算机化系统分类清单
序号 | 系统名称 | 分类结果 |
冻干机 | 4类 | |
灌装加塞机 | 4类 | |
自动进出料 | 4类 | |
AGV小车 | 4类 | |
立式超声波清洗机 | 4类 | |
热风循环隧道灭菌烘箱 | 4类 | |
全自动胶塞清洗机 | 4类 | |
全自动铝盖清洗机 | 4类 | |
扎盖机 | 4类 | |
配液系统 | 4类 | |
蒸汽式脉动真空灭菌柜 | 4类 | |
智能灯检机 | 4类 | |
贴签机 | 4类 | |
空调系统 | 4类 | |
环境监控系统 | 4类 | |
水分配系统 | 4类 |
无菌车间计算机化系统验证文件目录
序号 | 文件名称 | 文件编号 |
冻干粉针车间计算机化系统用户需求 | URS-01-01-01 | |
冻干粉针车间计算机化系统系统功能设计规范 | FDS-01-01-01 | |
冻干粉针车间计算机化系统系统硬件设计规范 | HDS-01-01-01 | |
冻干粉针车间计算机化系统系统软件设计规范 | SDS-01-01-01 | |
冻干粉针车间计算机化系统风险评估 | RA-01-01-01 | |
供应商审计方案 | AD-01-01-01 | |
供应商审计报告 | AD-01-02-01 | |
冻干粉针车间计算机化系统设计确认方案 | DQP-01-01-01 | |
冻干粉针车间计算机化系统设计确认报告 | DQR-01-01-01 | |
冻干粉针车间计算机化系统安装确认方案 | IQP-01-01-01 | |
冻干粉针车间计算机化系统安装确认报告 | IQR-01-01-01 | |
冻干粉针车间计算机化系统运行确认方案 | OQP-01-01-01 | |
冻干粉针车间计算机化系统运行确认报告 | OQR-01-01-01 | |
冻干粉针车间计算机化系统性能确认方案 | PQP-01-01-01 | |
冻干粉针车间计算机化系统性能确认报告 | PQR-01-01-01 | |
冻干粉针车间计算机化系统需求追溯矩阵 | RTM-01-01-01 | |
冻干粉针车间计算机化系统 Server风险回顾报告 | RAR-01-01-01 | |
冻干粉针车间计算机化系统验证总结报告 | VSR-01-01-01 |
口服固体车间计算机化系统分类清单
序号 | 系统名称 | 分类结果 |
流化床沸腾制粒干燥机 | 4类 | |
湿法混合制粒机 | 4类 | |
双出料高速压片机 | 4类 | |
流化床干燥制粒包衣机 | 4类 | |
高效包衣机 | 4类 | |
固定料斗混合机 | 4类 | |
全自动硬胶囊填充机 | 4类 | |
片剂包衣机 | 4类 | |
双铝遮光包衣机 | 4类 | |
离心式制丸机 | 4类 | |
装盒机 | 3类 | |
铝塑泡罩包装机 | 4类 | |
全自动水平式装盒机 | 4类 | |
高速泡罩机 | 4类 |
口服固体车间计算机化系统验证文件目录
序号 | 文件名称 | 文件编号 |
口服固体车间计算机化系统用户需求 | URS-01-01-01 | |
口服固体车间计算机化系统系统功能设计规范 | FDS-01-01-01 | |
口服固体车间计算机化系统系统硬件设计规范 | HDS-01-01-01 | |
口服固体车间计算机化系统系统软件设计规范 | SDS-01-01-01 | |
口服固体车间计算机化系统风险评估 | RA-01-01-01 | |
供应商审计方案 | AD-01-01-01 | |
供应商审计报告 | AD-01-02-01 | |
口服固体车间计算机化系统设计确认方案 | DQP-01-01-01 | |
口服固体车间计算机化系统设计确认报告 | DQR-01-01-01 | |
口服固体车间计算机化系统安装确认方案 | IQP-01-01-01 | |
口服固体车间计算机化系统安装确认报告 | IQR-01-01-01 | |
口服固体车间计算机化系统运行确认方案 | OQP-01-01-01 | |
口服固体车间计算机化系统运行确认报告 | OQR-01-01-01 | |
口服固体车间计算机化系统性能确认方案 | PQP-01-01-01 | |
口服固体车间计算机化系统性能确认报告 | PQR-01-01-01 | |
口服固体车间计算机化系统需求追溯矩阵 | RTM-01-01-01 | |
口服固体车间计算机化系统风险回顾报告 | RAR-01-01-01 | |
口服固体车间计算机化系统验证总结报告 | VSR-01-01-01 |
原料药车间计算机化系统分类清单
序号 | 系统名称 | 分类结果 |
结晶罐 | 3类 | |
离心机 | 3类 | |
干燥器 | 4类 | |
分装器 | 4类 | |
冻干机 | 4类 | |
发酵系统 | 4类 | |
提取系统 | 4类 | |
空调净化系统 | 4类 | |
蒸发浓缩罐 | 4类 | |
真空干燥器 | 4类 | |
PLG型喷雾干燥制粒机 | 4类 | |
洗药机 | 4类 | |
提取过滤器 | 4类 | |
纯沉罐 | 4类 | |
球磨机 | 4类 | |
隔离器 | 4类 |
原料药车间计算机化系统验证文件目录
序号 | 文件名称 | 文件编号 |
原料药车间计算机化系统用户需求 | URS-01-01-01 | |
原料药车间计算机化系统系统功能设计规范 | FDS-01-01-01 | |
原料药车间计算机化系统系统硬件设计规范 | HDS-01-01-01 | |
原料药车间计算机化系统系统软件设计规范 | SDS-01-01-01 | |
原料药车间计算机化系统风险评估 | RA-01-01-01 | |
供应商审计方案 | AD-01-01-01 | |
供应商审计报告 | AD-01-02-01 | |
原料药车间计算机化系统设计确认方案 | DQP-01-01-01 | |
原料药车间计算机化系统设计确认报告 | DQR-01-01-01 | |
原料药车间计算机化系统安装确认方案 | IQP-01-01-01 | |
原料药车间计算机化系统安装确认报告 | IQR-01-01-01 | |
原料药车间计算机化系统运行确认方案 | OQP-01-01-01 | |
原料药车间计算机化系统运行确认报告 | OQR-01-01-01 | |
原料药车间计算机化系统性能确认方案 | PQP-01-01-01 | |
原料药车间计算机化系统性能确认报告 | PQR-01-01-01 | |
原料药车间计算机化系统需求追溯矩阵 | RTM-01-01-01 | |
原料药车间计算机化系统风险回顾报告 | RAR-01-01-01 | |
原料药车间计算机化系统验证总结报告 | VSR-01-01-01 |
本文作者:东富龙智能殷志赟
本文来源:上海东富龙智能控制技术有限公司






共有条评论 网友评论